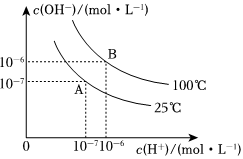
 在水的電離平衡中,c(H+)和c(OH-)的關系如圖所示:
在水的電離平衡中,c(H+)和c(OH-)的關系如圖所示:
(1)A點水的離子積為1×10-14�,B點水的離子積為
1×10-12
1×10-12
.
造成水的離子積變化的原因是 水的電離過程是吸熱的,升高溫度��,水的電離程度增大����,即水的離子積會增大
水的電離過程是吸熱的,升高溫度�����,水的電離程度增大�,即水的離子積會增大
(2)100℃時�����,若向溶液中滴加鹽酸��,能否使體系處于B點位置�����?為什么?
不會�����;氫離子濃度增大�����,氫氧根濃度減小���,但是溫度不變�,水的離子積不變
不會�;氫離子濃度增大,氫氧根濃度減小���,但是溫度不變,水的離子積不變
.
(3)100℃時�����,若鹽酸中c(H+)=5×10-4 mol?L-1����,則由水電離產生的c(H+)是多少�?